2022-2028年中国仿制药一致性评价行业分析与投资战略研究报告
http://www.cction.com 2022-04-14 11:31 中企顾问网
2022-2028年中国仿制药一致性评价行业分析与投资战略研究报告2022-4
- 价格(元):8000(电子) 8000(纸质) 8500(电子纸质)
- 出版日期:2022-4
- 交付方式:Email电子版/特快专递
- 订购电话:400-700-9228 010-69365838
- 2022-2028年中国仿制药一致性评价行业分析与投资战略研究报告,首先介绍了仿制药一致性评价行业市场发展环境、仿制药一致性评价整体运行态势等,接着分析了仿制药一致性评价行业市场运行的现状,然后介绍了仿制药一致性评价市场竞争格局。随后,报告对仿制药一致性评价做了重点企业经营状况分析,最后分析了仿制药一致性评价行业发展趋势与投资预测。您若想对仿制药一致性评价产业有个系统的了解或者想投资仿制药一致性评价行业,本报告是您不可或缺的重要工具。
- 下载WORD版 下载PDF版 订购单 订购流程
仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。对已经批准上市的仿制药进行一致性评价,这是补历史的课。因为过去批准上市的药品没有与原研药一致性评价的强制性要求,有些药品在疗效上与原研药存在一些差距。历史上,美国、日本等国家也都经历了同样的过程,日本用了十几年的时间推进仿制药一致性评价工作。开展仿制药一致性评价,可以使仿制药在质量和疗效上与原研药一致 ,在临床上可替代原研药,这不仅可以节约医疗费用,同时也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。
截止2020年5月17日,CDE共已受理1324个注射剂一致性评价,其中已有43个申请(视同)通过一致性评价,86个申请审评结束但暂未明确结论,1195个申请正在审评审批中。1195个正在审评审批的申请中,683个为存量注射剂品种的一致性评价补充申请,512个为按照新注册分类标准申报的上市申请。
已有43个注射剂品规(视同)通过一致性评价
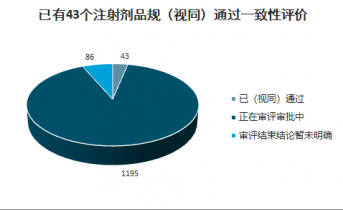
正在审评审批的大多为存量品种的一致性评价申请

数据来源:公开资料整理
中企顾问网发布的《2022-2028年中国仿制药一致性评价行业分析与投资战略研究报告》共十四章。首先介绍了仿制药一致性评价行业市场发展环境、仿制药一致性评价整体运行态势等,接着分析了仿制药一致性评价行业市场运行的现状,然后介绍了仿制药一致性评价市场竞争格局。随后,报告对仿制药一致性评价做了重点企业经营状况分析,最后分析了仿制药一致性评价行业发展趋势与投资预测。您若想对仿制药一致性评价产业有个系统的了解或者想投资仿制药一致性评价行业,本报告是您不可或缺的重要工具。
本研究报告数据主要采用国家统计数据,海关总署,问卷调查数据,商务部采集数据等数据库。其中宏观经济数据主要来自国家统计局,部分行业统计数据主要来自国家统计局及市场调研数据,企业数据主要来自于国统计局规模企业统计数据库及证券交易所等,价格数据主要来自于各类市场监测数据库。
报告目录:
1.1 仿制药一致性评价行业定义及分类
1.1.1 行业定义
1.1.2 行业主要产品分类
1.1.3 行业主要商业模式
1.2 仿制药一致性评价行业特征分析
1.2.1 产业链分析
1.2.2 仿制药一致性评价行业在国民经济中的地位
1.2.3 仿制药一致性评价行业生命周期分析
(1)行业生命周期理论基础
(2)仿制药一致性评价行业生命周期
1.3 最近3-5年中国仿制药一致性评价行业经济指标分析
1.3.1 赢利性
1.3.2 成长速度
1.3.3 附加值的提升空间
1.3.4 进入壁垒/退出机制
1.3.5 风险性
1.3.6 行业周期
1.3.7 竞争激烈程度指标
1.3.8 行业及其主要子行业成熟度分析
第二章 仿制药一致性评价行业运行环境分析
2.1 仿制药一致性评价行业政治法律环境分析
2.1.1 行业管理体制分析
2.1.2 行业主要法律法规
2020年5月14日,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)》,明确:已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。2020年5月14日,国家药品监督管理局药品审评中心发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》
仿制药一致性评价政策
发文时间 | 发文部门 | 发文时间 | 发文部门 | 主要内容 |
2016.05.26 | 国家食品药品监督管理局 | 《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》 | 国食药监[2016]106号 | 对一致性评价的药品目录,研究内容,程序等相关内容进行了规定,进一步推进药品一致性评价。 |
2016.07.01 | 国家食品药品监督管理局 | 《关于研制过程中所需研究用对照药品一次性进口有关事宜的意见》 | 国食药监[2016]120号 | 对于已在中国境外上市但尚未在中国境内批准上市的药品的进口申报和申报内容进行了规定。 |
2016.08.17 | 国家食品药品监督管理局 | 《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》 | 国食药监[2016]120号 | 对化学药品仿制药口服固体制剂质量和疗效一致性评价的申报材料和内容进行了规定。 |
2017.02.07 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价临床有效性试验一般考虑》 | 国食药监[2017]18号 | 对于找不到或无法确定参比制剂的,需开展临床有效性试验的仿制药一致性评价的方法进行了规定。 |
2017.02.17 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改盐基药品评价一般考虑》 | 国食药监[2017]27号 | 对于口服固体制剂中改规格,改剂型和改盐基这三类药品的一致性评价的的方法进行了规定。 |
2017.04.05 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价品种分类指导意见》 | 国食药监[2017]49号 | 为了推动仿制药质量和疗效一致性评价,对药品的品种进行了分类。 |
2017.05.18 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价研究现场核查指导原则》《仿制药质量和疗效一致性评价生产现场检查指导原则》《仿制药质量和疗效一致性评价临床试验数据核查指导原则》《仿制药质量和疗效一致性评价有因检查指导原则》 | 国食药监[2017]77号 | 对于仿制药质量和疗效一致性评价中研究现场核查的各个方面内容进行了规定。 |
2017.08.25 | 国家食品药品监督管理局 | 《关于仿制药质量和疗效一致性评价工作有关事项的公告》 | 国食药监[2017]100号 | 对一致性评价工作各环节进行了优化调整。 |
2017.10.08 | 中共中央办公厅,国务院办公厅 | 《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》 | 厅字(2017)42号 | 提出深化改革审评审批制度,鼓励药品医疗器械创新。 |
数据来源:公开资料整理
2.1.3 行业相关发展规划
2.2 仿制药一致性评价行业经济环境分析
2.2.1 国际宏观经济形势分析
2.2.2 国内宏观经济形势分析
2.2.3 产业宏观经济环境分析
2.3 仿制药一致性评价行业社会环境分析
2.3.1 仿制药一致性评价产业社会环境
2.3.2 社会环境对行业的影响
2.3.3 仿制药一致性评价产业发展对社会发展的影响
2.4 仿制药一致性评价行业技术环境分析
2.4.1 仿制药一致性评价技术分析
2.4.2 仿制药一致性评价技术发展水平
2.4.3 行业主要技术发展趋势
第三章 我国仿制药一致性评价行业运行分析
3.1 我国仿制药一致性评价行业发展状况分析
3.1.1 我国仿制药一致性评价行业发展阶段
3.1.2 我国仿制药一致性评价行业发展总体概况
3.1.3 我国仿制药一致性评价行业发展特点分析
3.2 2015-2019年仿制药一致性评价行业发展现状
截至2020年5月17日,注射剂一致性评价,通过企业数量最多的品种为布洛芬、盐酸阿芬太尼、左乙拉西坦注射液等,通过品种数量最多的企业包括四川汇宇、恒瑞医药、人福药业、大冢制药等。目前已经通过的品种主要为按照新3/4类申报生产后获批的注射剂,上市后视同通过一致性评价。同时,少量产品通过补充申请的路径获批,但均是在海外上市、海内外共线的品种。
(视同)申请注射剂一致性评价品种最多的企业统计

数据来源:公开资料整理
3.2.1 2015-2019年我国仿制药一致性评价行业市场规模
3.2.2 2015-2019年我国仿制药一致性评价行业发展分析
3.2.3 2015-2019年中国仿制药一致性评价企业发展分析
3.3 区域市场分析
3.3.1 区域市场分布总体情况
3.3.2 2015-2019年重点省市市场分析
3.4 仿制药一致性评价细分产品/服务市场分析
3.4.1 细分产品/服务特色
3.4.2 2015-2019年细分产品/服务市场规模及增速
3.4.3 重点细分产品/服务市场前景预测
3.5 仿制药一致性评价产品/服务价格分析
3.5.1 2015-2019年仿制药一致性评价价格走势
3.5.2 影响仿制药一致性评价价格的关键因素分析
(1)成本
(2)供需情况
(3)关联产品
(4)其他
3.5.3 2022-2028年仿制药一致性评价产品/服务价格变化趋势
3.5.4 主要仿制药一致性评价企业价位及价格策略
第四章 我国仿制药一致性评价所属行业整体运行指标分析
4.1 2015-2019年中国仿制药一致性评价所属行业总体规模分析
4.1.1 企业数量结构分析
4.1.2 人员规模状况分析
4.1.3 行业资产规模分析
4.1.4 行业市场规模分析
4.2 2015-2019年中国仿制药一致性评价所属行业产销情况分析
4.2.1 我国仿制药一致性评价所属行业工业总产值
4.2.2 我国仿制药一致性评价所属行业工业销售产值
4.2.3 我国仿制药一致性评价所属行业产销率
4.3 2015-2019年中国仿制药一致性评价所属行业财务指标总体分析
4.3.1 行业盈利能力分析
4.3.2 行业偿债能力分析
4.3.3 行业营运能力分析
4.3.4 行业发展能力分析
第五章 我国仿制药一致性评价行业供需形势分析
5.1 仿制药一致性评价行业供给分析
5.1.1 2015-2019年仿制药一致性评价行业供给分析
5.1.2 2022-2028年仿制药一致性评价行业供给变化趋势
5.1.3 仿制药一致性评价行业区域供给分析
5.2 2015-2019年我国仿制药一致性评价行业需求情况
5.2.1 仿制药一致性评价行业需求市场
5.2.2 仿制药一致性评价行业客户结构
5.2.3 仿制药一致性评价行业需求的地区差异
5.3 仿制药一致性评价市场应用及需求预测
5.3.1 仿制药一致性评价应用市场总体需求分析
(1)仿制药一致性评价应用市场需求特征
(2)仿制药一致性评价应用市场需求总规模
5.3.2 2022-2028年仿制药一致性评价行业领域需求量预测
(1)2022-2028年仿制药一致性评价行业领域需求产品/服务功能预测
(2)2022-2028年仿制药一致性评价行业领域需求产品/服务市场格局预测
5.3.3 重点行业仿制药一致性评价产品/服务需求分析预测
第六章 仿制药一致性评价行业产业结构分析
6.1 仿制药一致性评价产业结构分析
6.1.1 市场细分充分程度分析
6.1.2 各细分市场领先企业排名
6.1.3 各细分市场占总市场的结构比例
6.1.4 领先企业的结构分析(所有制结构)
6.2 产业价值链条的结构分析及产业链条的整体竞争优势分析
6.2.1 产业价值链条的构成
6.2.2 产业链条的竞争优势与劣势分析
6.3 产业结构发展预测
6.3.1 产业结构调整指导政策分析
6.3.2 产业结构调整中消费者需求的引导因素
6.3.3 中国仿制药一致性评价行业参与国际竞争的战略市场定位
6.3.4 产业结构调整方向分析
第七章 我国仿制药一致性评价行业产业链分析
7.1 仿制药一致性评价行业产业链分析
7.1.1 产业链结构分析
7.1.2 主要环节的增值空间
7.1.3 与上下游行业之间的关联性
7.2 仿制药一致性评价上游行业分析
7.2.1 仿制药一致性评价产品成本构成
7.2.2 2015-2019年上游行业发展现状
7.2.3 2022-2028年上游行业发展趋势
7.2.4 上游供给对仿制药一致性评价行业的影响
7.3 仿制药一致性评价下游行业分析
7.3.1 仿制药一致性评价下游行业分布
7.3.2 2015-2019年下游行业发展现状
7.3.3 2022-2028年下游行业发展趋势
7.3.4 下游需求对仿制药一致性评价行业的影响
第八章 我国仿制药一致性评价行业渠道分析及策略
8.1 仿制药一致性评价行业渠道分析
8.1.1 渠道形式及对比
8.1.2 各类渠道对仿制药一致性评价行业的影响
8.1.3 主要仿制药一致性评价企业渠道策略研究
8.1.4 各区域主要代理商情况
8.2 仿制药一致性评价行业用户分析
8.2.1 用户认知程度分析
8.2.2 用户需求特点分析
8.2.3 用户购买途径分析
8.3 仿制药一致性评价行业营销策略分析
8.3.1 中国仿制药一致性评价营销概况
8.3.2 仿制药一致性评价营销策略探讨
8.3.3 仿制药一致性评价营销发展趋势
第九章 我国仿制药一致性评价行业竞争形势及策略
9.1 行业总体市场竞争状况分析
9.1.1 仿制药一致性评价行业竞争结构分析
(1)现有企业间竞争
(2)潜在进入者分析
(3)替代品威胁分析
(4)供应商议价能力
(5)客户议价能力
(6)竞争结构特点总结
9.1.2 仿制药一致性评价行业企业间竞争格局分析
9.1.3 仿制药一致性评价行业集中度分析
9.1.4 仿制药一致性评价行业SWOT分析
9.2 中国仿制药一致性评价行业竞争格局综述
9.2.1 仿制药一致性评价行业竞争概况
(1)中国仿制药一致性评价行业竞争格局
(2)仿制药一致性评价行业未来竞争格局和特点
(3)仿制药一致性评价市场进入及竞争对手分析
9.2.2 中国仿制药一致性评价行业竞争力分析
(1)我国仿制药一致性评价行业竞争力剖析
(2)我国仿制药一致性评价企业市场竞争的优势
(3)国内仿制药一致性评价企业竞争能力提升途径
9.2.3 仿制药一致性评价市场竞争策略分析
第十章 仿制药一致性评价行业领先企业经营形势分析
10.1 杭州泰格医药科技股份有限公司
10.1.1 企业概况
10.1.2 企业优势分析
10.1.3 产品/服务特色
10.1.4 公司经营状况
10.1.5 公司发展规划
10.2 浙江华海药业股份有限公司
10.2.1 企业概况
10.2.2 企业优势分析
10.2.3 产品/服务特色
10.2.4 公司经营状况
10.2.5 公司发展规划
10.3 深圳市海王生物工程股份有限公司
10.3.1 企业概况
10.3.2 企业优势分析
10.3.3 产品/服务特色
10.3.4 公司经营状况
10.3.5 公司发展规划
10.4 安徽山河药用辅料股份有限公司
10.4.1 企业概况
10.4.2 企业优势分析
10.4.3 产品/服务特色
10.4.4 公司经营状况
10.4.5 公司发展规划
10.5 浙江京新药业股份有限公司
10.5.1 企业概况
10.5.2 企业优势分析
10.5.3 产品/服务特色
10.5.4 公司经营状况
10.5.5 公司发展规划
10.6 深圳信立泰药业股份有限公司
10.6.1 企业概况
10.6.2 企业优势分析
10.6.3 产品/服务特色
10.6.4 公司经营状况
10.6.5 公司发展规划
第十一章 2022-2028年仿制药一致性评价行业投资前景
11.1 2022-2028年仿制药一致性评价市场发展前景
11.1.1 2022-2028年仿制药一致性评价市场发展潜力
11.1.2 2022-2028年仿制药一致性评价市场发展前景展望
11.1.3 2022-2028年仿制药一致性评价细分行业发展前景分析
11.2 2022-2028年仿制药一致性评价市场发展趋势预测
11.2.1 2022-2028年仿制药一致性评价行业发展趋势
11.2.2 2022-2028年仿制药一致性评价市场规模预测
11.2.3 2022-2028年仿制药一致性评价行业应用趋势预测
11.2.4 2022-2028年细分市场发展趋势预测
11.3 2022-2028年中国仿制药一致性评价行业供需预测
11.3.1 2022-2028年中国仿制药一致性评价行业供给预测
11.3.2 2022-2028年中国仿制药一致性评价行业需求预测
11.3.3 2022-2028年中国仿制药一致性评价供需平衡预测
11.4 影响企业生产与经营的关键趋势
11.4.1 市场整合成长趋势
11.4.2 需求变化趋势及新的商业机遇预测
11.4.3 企业区域市场拓展的趋势
11.4.4 科研开发趋势及替代技术进展
11.4.5 影响企业销售与服务方式的关键趋势
第十二章 2022-2028年仿制药一致性评价行业投资机会与风险
12.1 仿制药一致性评价行业投融资情况
12.1.1 行业资金渠道分析
12.1.2 固定资产投资分析
12.1.3 兼并重组情况分析
12.2 2022-2028年仿制药一致性评价行业投资机会
12.2.1 产业链投资机会
12.2.2 细分市场投资机会
12.2.3 重点区域投资机会
12.3 2022-2028年仿制药一致性评价行业投资风险及防范
12.3.1 政策风险及防范
12.3.2 技术风险及防范
12.3.3 供求风险及防范
12.3.4 宏观经济波动风险及防范
12.3.5 关联产业风险及防范
12.3.6 产品结构风险及防范
12.3.7 其他风险及防范
第十三章 仿制药一致性评价行业投资战略研究
13.1 仿制药一致性评价行业发展战略研究
13.1.1 战略综合规划
13.1.2 技术开发战略
13.1.3 业务组合战略
13.1.4 区域战略规划
13.1.5 产业战略规划
13.1.6 营销品牌战略
13.1.7 竞争战略规划
13.2 对我国仿制药一致性评价品牌的战略思考
13.2.1 仿制药一致性评价品牌的重要性
13.2.2 仿制药一致性评价实施品牌战略的意义
13.2.3 仿制药一致性评价企业品牌的现状分析
13.2.4 我国仿制药一致性评价企业的品牌战略
13.2.5 仿制药一致性评价品牌战略管理的策略
13.3 仿制药一致性评价经营策略分析
13.3.1 仿制药一致性评价市场细分策略
13.3.2 仿制药一致性评价市场创新策略
13.3.3 品牌定位与品类规划
13.3.4 仿制药一致性评价新产品差异化战略
13.4 仿制药一致性评价行业投资战略研究
13.4.1 2019年仿制药一致性评价行业投资战略
13.4.2 2022-2028年仿制药一致性评价行业投资战略
13.4.3 2022-2028年细分行业投资战略
第十四章 研究结论及投资建议()
14.1 仿制药一致性评价行业研究结论
14.2 仿制药一致性评价行业投资价值评估
14.3 仿制药一致性评价行业投资建议
14.3.1 行业发展策略建议
14.3.2 行业投资方向建议
14.3.3 行业投资方式建议()








